 Dalam beberapa pelajaran kimia ataupun fisika di SMA dan mata kuliah beberapa jurusan di perguruan tinggi, sering dibicarakan istilah massa atom, nomer atom dan isotop. Ketiga istilah ini sangat erat hubungannya dalam pembangkitan energi nuklir. Meskipun sebenarnya masih terdapat istilah isobar, dan isoton, namun terkadang kita hanya mengerti sekilas tentang istilah ini, pada tulisan ini akan dibahas sedikit mendalam tentang istilah tersebut.
Dalam beberapa pelajaran kimia ataupun fisika di SMA dan mata kuliah beberapa jurusan di perguruan tinggi, sering dibicarakan istilah massa atom, nomer atom dan isotop. Ketiga istilah ini sangat erat hubungannya dalam pembangkitan energi nuklir. Meskipun sebenarnya masih terdapat istilah isobar, dan isoton, namun terkadang kita hanya mengerti sekilas tentang istilah ini, pada tulisan ini akan dibahas sedikit mendalam tentang istilah tersebut.
Nomer Atom dan Massa Atom
Untuk unsur yang diketahui, jumlah proton yang ada dalam inti atom adalah sama dengan jumlah muatan positif yang dibawanya, nilai tersebut dikenal dengan sebutan Nomer Atom unsur. Biasanya di lambangkan dengan simbol Z. Sebagai contoh nomer atom dari hidrogen adalah 1 , Helium adalah 2, dan Lithium adalah 3 begitulah seterusnya hingga Uranium – unsur alam dengan massa atom terbesar – dengan nomer atom 92. Sejumlah unsur yang lebih berat – yang penting dalam hubungannya dengan pembangkitan Energi Nuklir -, semisal Plutonium dengan Nomer Atom 94 merupakan unsur buatan manusia.
Jumlah proton dan neutron dalam inti atom disebut dengan nomer massa unsur dan dilambangkan dengan A. Seperti yang telah dijelaskan bahwa jumlah proton dalam suatu inti sama dengan Z, sehingga jumlah neutron dari unsur yang diketahui adalah sama dengan A – Z. Karena neutron dan proton memiliki massa yang mendekati 1 pada skala amu ( massa proton =1,00758 amu sedangkan massa neutron = 1,00897), maka untuk pendekatan, nomer massa ditulis dalam bilangan bulat.
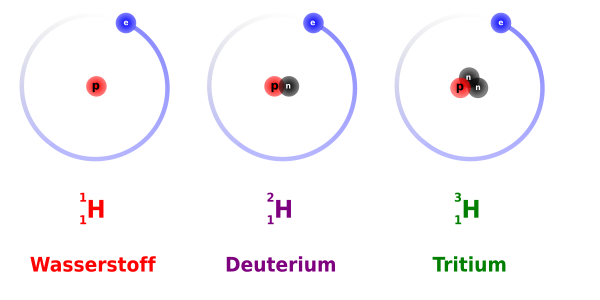
Isotop dan Nuklida
Adalah Nomer atom, yakni jumlah proton – bukannya massa atom – yang menentukan jenis dan sifat kimia dari suatu unsur. Hal ini dikarenakan sifat – sifat kimia bergantung pada komposisi elektron – elektron sedangkan jumlah elektron adalah sama dengan nomer atom. Konsekuensinya, atom dengan inti yang berisi jumlah proton yang sama ( nomer atom sama) tetapi jumlah neutron yang berbeda (nomer massa berbeda) –disebut dengan isotop- pada dasarnya secara kimiawi adalah identik meskipun hal ini sering menandakan perbedaan dari segi kestabilan inti atom.
Sebagian besar unsur di alam berada dalam dua atau lebih isotop stabil yang mana secara kimiawi hampir tidak bisa dibedakan meskipun nomer massanya dan berat atomnya berbeda. Kesemuanya, sekitar 280 isotop stabil yang telah di identifikasi terjadi secara alamiah, dan sebagai tambahan, terdapat sekitar 50 jenis isotop tidak stabil yang ditemukan di alam. Lainnya 700 atau lebih isotop tidak stabil didapatkan secara buatan dengan reaksi nuklir yang beragam. Untuk tujuan membedakan perbedaan dari isotop –isotop dari unsur tertentu maka dicantumkan nomer massa yang digunakan setelah simbol unsur. Jadi isotop uranium dengan nomer massa 238 bisa ditulis sebagai uranium -238, U-238 atau U238
Uranium, unsur paling penting dalam pembangkitan energi nuklir, berada di alam dalam setidaknya tiga bentuk isotop dengan nomer massa 234, 235, dan 238. Uranium – 238 merupakan isotop yang paling banyak proporsinya berada di alam (99,282 %). Sedangkan U-235 sekitar 0,7% dan untuk uranium – 234 lebih kecil lagi, sehingga sering bisa diabaikan.
Referensi
Glasstone, Samuel.The Elements of Nuclear Reactor Theory. D Van Nostrand Company Inc.
Tidak ada komentar:
Posting Komentar