Antoine
Laurent Lavoisier (1743–1794) seorang ahli kimia berkebangsaan Prancis telah
menyelidiki hubungan massa zat sebelum dan sesudah reaksi. Lavoisier menimbang
zat-zat sebelum bereaksi kemudian menimbang hasil-hasil reaksinya. Ternyata
massa zat sebelum dan sesudah bereaksi selalu sama. Akan tetapi,
perubahan-perubahan materi umumnya berlangsung dalam sistem terbuka sehingga
apabila hasil reaksi ada yang meninggalkan sistem (seperti pembakaran lilin)
atau apabila sesuatu zat dari lingkungan diikat (seperti proses perkaratan besi
yang mengikat oksigen dari udara) maka seolah-olah massa zat sebelum dan
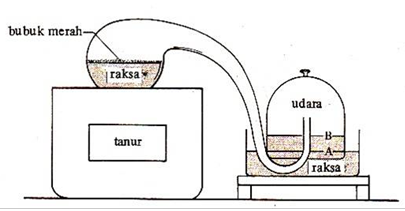
sesudah reaksi menjadi tidak sama. Dari percobaan yang dilakukan Lavoisier
terhadap merkuri cair dan oksigen hingga terbentuk merkuri oksida yang berwarna
merah, Lavoiser mengambil kesimpulan yang dikenal dengan hukum kekekalan
massa (hukum Lavoisier) yaitu: "Dalam sistem tertutup, massa zat
sebelum dan sesudah reaksi adalah sama".
Percobaan yang dilakukan lavoiser.
Contoh Hukum Kekekalan Massa
Hukum
kekekalan massa dapat terlihat pada reaksi pembentukan hidrogen dan oksigen
dari air. Bila hidrogen dan oksigen dibentuk dari 36 g air, maka bila reaksi
berlangsung hingga seluruh air habis, akan diperoleh massa campuran produk
hidrogen dan oksigen sebesar 36 g. Bila reaksi masih menyisakan air, maka massa
campuran hidrogen, oksigen dan air yang tidak bereaksi tetap sebesar 36 g.
Air -> Hidrogen + Oksigen (+ Air)
(36 g) (36 g)
Apabila kita membakar kayu misalnya
kayu korek api. Berlaku juga hukum kekekalan massa. Memang setelah kayu
terbakar akan menjadi abu. Namun yang perlu anda ketahui adalah bahwa selain
abu, pada pembakaran kayu juga dihasilkan oksida karbon, asap dan uap air.
Oksida carbon dan uap air tidak tampak oleh mata karena bermujud gas. Jika
ditimbang ulang :
Tidak ada komentar:
Posting Komentar